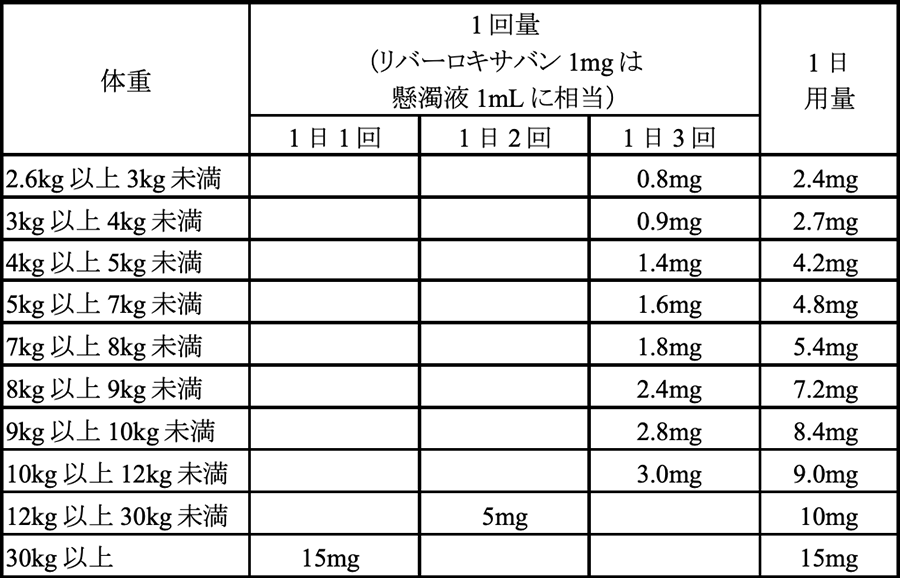
- 下肢血行再建術施行後の末梢動脈疾患(PAD)患者への有用性が示された初めての抗凝固薬
- 2つの経路でアプローチする新たな治療選択肢
- 4つの適応と4つの剤形を持つ唯一の直接作用型経口抗凝固薬(DOAC)
大阪、2022年10月24日 ― バイエル薬品株式会社(本社:大阪市、代表取締役社長:フリオ・トリアナ、以下「バイエル薬品」)は、選択的直接作用型第Ⅹa因子阻害剤(経口抗凝固薬)イグザレルト®(一般名:リバーロキサバン)について、新たに承認を取得した下肢血行再建術施行後のPAD患者に用いる「イグザレルト®錠2.5mg」を本日、発売しましたのでお知らせします。イグザレルト®は、下肢血行再建術施行後のPAD患者における有用性が示された初めての抗凝固薬であり、抗凝固療法と抗血小板療法の2つの経路でアプローチする新たな治療選択肢を提供します。
PADは主に、動脈にプラークが蓄積し、手足への血流を制限する慢性進行性疾患であるアテローム性動脈硬化症が原因で起こります。PAD患者は、既存の治療にもかかわらず、脳梗塞、心筋梗塞、突然死などの心血管イベントのリスクが依然として高いままです。下肢血行再建術施行後のPAD患者では、患肢の再発リスクに加え、対側肢のPAD発症リスク、心血管イベントや死亡のリスクにも注意が必要です。こうしたアンメット・メディカル・ニーズへ対応するための新たな治療選択肢として、イグザレルト®を加えた2つの経路でのアプローチ、すなわちアスピリンによる抗血小板療法に、抗凝固療法としてほかの成人適応より少ない用量のイグザレルト®を上乗せする治療法が可能になりました。
イグザレルト®の下肢血行再建術施行後のPAD患者に対する適応は、下肢血行再建術施行後の症候性PAD患者6,500人以上が参加した第Ⅲ相臨床試験VOYAGER PADのデータに基づき承認されました。VOYAGER PAD試験では、アスピリン(100mg 1日1回投与)に、ほかの成人適応より少量のリバーロキサバン(2.5mg 1日2回投与)を上乗せした場合、安全性主要評価項目(TIMI分類に基づく重大な出血事象)の発現を有意に増やさずに、有効性主要評価項目の複合エンドポイント(急性下肢虚血、血管系の病因による大切断、心筋梗塞、虚血性脳卒中または心血管死)の発現を15%有意に低下させることが示されました。本データは、医学誌ニュー・イングランド・ジャーナル・オブ・メディシンに掲載されています1。
バイエル薬品は血栓症領域に注力しています。イグザレルト®を2012年に日本発売して以降も、患者さんと医療関係者のニーズに対応するため適応拡大と剤形追加を続け、発売10周年を迎えたイグザレルト®は4適応、4剤形を持つ唯一のDOACとなりました。また、血栓症領域におけるより安全性の高い薬剤へのニーズを捉え、第Ⅺ因子阻害剤の臨床開発を進めており、バイエル薬品は患者さんのQOL向上へさらなる貢献を目指します。